Nahezu 1 Jahr medianes progressionsfreies Überleben unter Everolimus
Mit der Zulassung von Afinitor® (Everolimus, RAD001) durch die europäische Kommission am 23. Juli 2012 steht erstmals das Wirkprinzip der mTOR-Inhibition für die Therapie des fortgeschrittenen Mammakarzinoms zur Verfügung. Everolimus wird in Kombination mit Exemestan zur Therapie des Hormonrezeptor-positiven (HR+), HER2/neu-negativen, fortgeschrittenen Mammakarzinoms bei postmenopausalen Frauen ohne symptomatische viszerale Metastasierung eingesetzt, nachdem es zu einem Rezidiv oder einer Progression nach einem nicht-steroidalen Aromataseinhibitor gekommen ist [2].
Die Kombination des mTOR-Inhibitors Everolimus mit Exemestan stellt für betroffene
Patientinnen im fortgeschrittenen Stadium einen Durchbruch dar: In der zentralen Auswertung
der randomisierten, doppelblinden, placebokontrollierten, multizentrischen Phase-III-Studie
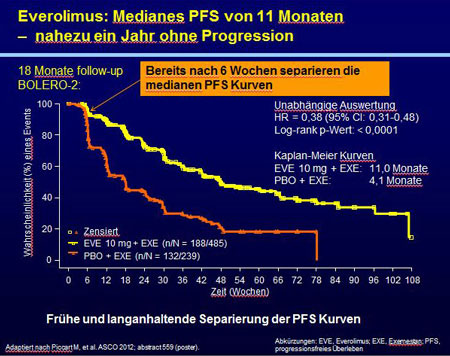
BOLERO-2 beträgt im 18-Monats-Follow-up das mediane progressionsfreie Überleben (PFS)
mit der Kombination von Everolimus und Exemestan 11,0 Monate verglichen mit 4,1 Monaten
unter der Therapie mit Placebo und Exemestan (HR 0,38 [95% KI:0,31-0,48]; p< 0,0001) [1].
Die Kaplan-Meier-Kurven zum PFS zeigen dabei eine frühzeitige und langanhaltende Separierung (Abb.) [1].
|
Die Ergebnisse bezüglich des klinischen Nutzens in der BOLERO-2-Studie zeigen, dass mit 51,3%
unter Everolimus und Exemestan durchschnittlich jede zweite Patientin profitiert,
verglichen mit 26,4% unter der Therapie mit Placebo und Exemestan (p< 0,0001).
Der klinische Nutzen war dabei definiert als Summe von komplettem Ansprechen,
partiellem Ansprechen und einer stabilen Erkrankung über mindestens 24 Wochen
nach RECIST-Kriterien. Ausgewertet wurden in der BOLERO-2-Studie Daten von
724 postmenopausalen Frauen mit einem Durchschnittsalter von 62 Jahren. Die
Patientinnen wurden im Verhältnis 2:1 randomisiert und erhielten entweder
Everolimus (10 mg/Tag) plus Exemestan
(25 mg/Tag) oder Placebo plus Exemestan (25 mg/Tag).
Die Mehrheit der in die BOLERO-2-Studie eingeschlossenen Patientinnen befand sich
in der ersten oder zweiten Linie in der fortgeschrittenen Situation [1].
Patientinnen in allen Subgruppen profitieren von Everolimus
Im Rahmen der Zulassungsstudie konnte gezeigt werden, dass Patientinnen
mit Everolimus und Exemestan in allen vordefinierten Subgruppen mit einer
signifikanten Verlängerung des medianen PFS gegenüber der Kontrollgruppe
profitierten. Dies galt sowohl unabhängig von der geografischen Herkunft der
Patientinnen als auch unabhängig von der Wirksamkeit einer früheren Hormontherapie,
Anzahl und Art der Vortherapien (Chemotherapie), der Anzahl betroffener Organe,
dem Status der Knochenmetastasen zu Behandlungsbeginn sowie vom Alter. Der
signifikante Vorteil hinsichtlich des medianen PFS galt darüber hinaus auch für
die insgesamt 56% der Patientinnen, bei denen bei Studienbeginn eine viszerale
Metastasierung vorlag [1].
In den Interimsanalysen der BOLERO-2-Studie zeigte sich ein positiver Trend
zum längeren Gesamtüberleben für Everolimus und Exemestan, die finale Auswertung
zum Gesamtüberleben steht noch aus [1].
Die neu zugelassene Therapieoption könnte zu einem Paradigmenwechsel bei der
Therapie von Patientinnen mit fortgeschrittenem HR+, HER2/neu-negativem Mammakarzinom
führen. Die AGO hat die Kombinationstherapie bereits als Empfehlung in ihre
Leitlinien für 2012 aufgenommen [3].
Strategie des dualen Wirkansatzes: Überwindung der Resistenz
Für Patientinnen mit Hormonrezeptor-positivem Mammakarzinom ist eine endokrine
Behandlung Therapie der Wahl [4]. Allerdings spricht etwa die Hälfte der Patientinnen
mit fortgeschrittenem HR+, HER2/neu-negativem Mammakarzinom nicht auf die initiale
endokrine Therapie an. Zusätzlich entwickeln nahezu alle Patientinnen eine Resistenz [5, 6].
In Studien konnte gezeigt werden, dass die Überaktivierung des PI3K/AKT/mTOR-Signalwegs
zum Östrogenrezeptor eine entscheidende Rolle sowohl für die Resistenzentwicklung
als auch für die Tumorprogression spielt [7,8,9,10,11]. Die kombinierte Behandlungsstrategie
mit Everolimus und Exemestan erscheint daher sinnvoll [12], um die bestehende Resistenz
zu überwinden.
Afinitor® - gut etabliertes Verträglichkeitsprofil
Das Mammakarzinom ist die dritte onkologische Indikation, für die Afinitor®
zugelassen ist. Die Einnahme des Wirkstoffs erfolgt einmal täglich oral in einer
Dosierung von 10 mg/Tag in Kombination mit 25 mg/Tag Exemestan [2]. Mit dem mTOR-Inhibitor
wurden seit dem Jahre 2009 weltweit mehr als 38.000 Patienten in onkologischen Indikationen
behandelt, so dass der Wirkstoff über ein gut etabliertes Verträglichkeitsprofil verfügt:
Zu den häufigsten Nebenwirkungen aller Grade gehörten Stomatitis (59%), Hautausschlag (39%),
Fatigue (37%), Diarrhö (34%), Übelkeit (31%), Appetitverlust (31%), nicht-infektiöse
Pneumonitis (16%) sowie Hyperglykämie (14%) [1]. Von klinischem Interesse ist
aufgrund des neuen Wirkprinzips der mTOR-Inhibition beim Mammakarzinom insbesondere
die nicht-infektiöse Pneumonitis, die als Klasseneffekt der mTOR-Inhibitoren auftreten
kann.
Auch die Zeit bis zur Verschlechterung der Lebensqualität war unter der Kombination
von Everolimus mit Exemestan signifikant länger als unter Placebo [13]. Die mediane
Zeit bis zur Verschlechterung der gesundheitsbezogenen Lebensqualität um mehr als 5%
im Vergleich zum Ausgangswert (TTD, Time To definitive Deterioration) lag unter der
Kombination aus Everolimus und Exemestan bei 8,3 Monaten und unter der Kombination
Placebo und Exemestan bei 5,8 Monaten (p=0,0084) [13]. Die Lebensqualität wurde
mittels eines standardisierten Fragebogens der EORTC ermittelt.
Weitere Studien zum Einsatz von Everolimus beim Mammakarzinom
Der Stellenwert der mTOR-Inhibition mit Everolimus in Kombination mit Exemestan wird
aktuell unter anderem in der Studie "4EVER" weiter geprüft. Die multizentrische,
offene, einarmige Studie soll weiteren Aufschluss zur Wirksamkeit, Sicherheit,
Lebensqualität und zu pharmaökonomischen Aspekten der Therapie geben [14].
Literaturhinweise: Quelle: Pressekonferenz "Zulassung des mTOR-Inhibitors Afinitor®: Durchbruch in der
Therapie des fortgeschrittenen Mammakarzinoms" in Köln-Hürth, am 6. September 2012. Veranstalter: Novartis Oncology
[1] Piccart M et al.: Everolimus for postmenopausal women with advanced breast cancer. J Clin Oncol 2012; 30 (Suppl., Abstr. # 559).
[2] Fachinformation Afinitor® (Everolimus); Stand: Juli 2012.
[3] Arbeitsgemeinschaft Gynäkologische Onkologie e.V. (AGO). Guidelines Breast 2012.1D.
[4] Wilcken N et al.: Chemotherapy alone versus endocrine therapy alone for metastatic breast cancer.
Cochrane Database Syst Rev 2003;(2):CD002747.
[5] Normanno N et al.: NCI-Naples Breast Cancer Group. Mechanisms of endocrine resistance and novel therapeutic
strategies in breast cancer. Endocr Relat Cancer 2005; 12(4):721-747.
[6] Pink JJ et al.: Irreversible loss of the oestrogen receptor in T47D breast cancer cells following
prolonged oestrogen deprivation. Br J Cancer 1996; 74(8):1227-1236.
[7] Burstein HJ et al.: Novel agents and future directions for refractory breast cancer. Semin Oncol 2011; 38(2): S17-S24.
[8] Johnston SR et al.: Clinical efforts to combine endocrine agents with targeted therapies
against epidermal growth factor receptor/human epidermal growth factor receptor 2 and mammalian target of
rapamycin in breast cancer. Clin Cancer Res 2006; 12:1061S-1068S.
[9] Schiff R et al.: Cross-talk between estrogen receptor and growth factor pathways as a molecular
target for overcoming endocrine resistance. Clin Cancer Res 2004; 10:331S-336S.
[10] Fang L et al.: Targeted therapy in breast cancer: what's new? Swiss Med Wkly 2011; 141: w13231.
[11] Margariti N et al.: Overcoming breast cancer drug resistance with mTOR inhibitors. Could it be
a myth or a real possibility in the short-term future? Breast Cancer Res Treat 2011; 128:599-606.
[12] Boulay A et al.: Dual inhibition of mTOR and estrogen receptor signaling in vitro induces cell
death in models of breast cancer. Clin Cancer Res 2005; 11(14): 5319-5328.
[13] Beck JT et al.: BOLERO-2: Health-related quality-of-life in metastatic breast cancer patients
treated with everolimus and exemestane versus exemestane. J Clin Oncol 2012; 30 (Suppl., Abstr. #539).
[14] NCT01626222: A phase IIIb, multi-center, open label study for postmenopausal women with estrogen
receptor positive locally advanced or metastatic breast cancer treated with everolimus (RAD001) in combination
with exemestane: 4EVER - efficacy, safety, health economics, translational research. Novartis Pharmaceuticals.
Online unter: http://www.clinicaltrials.gov/ct2/show/NCT01626222.
Zuletzt aufgerufen am 22.08.2012.
| September 2012 |
Printversion |
 Inhalt
InhaltVulväre intraepitheliale Neoplasie
Präinvasive genitale Läsionen mit erheblich ange stiegener Inzidenzrate
Literaturreferate
GeparQuattro-Studie:
Neoadjuvante Therapie mit Trastuzu-
Capecitabin zu Anthrazyklin- und Taxan-basierter neoadjuvanter Therapie bei primärem Brustkrebs
Paclitaxel dosisdicht bei fortgeschrittenem Ovarialkrebs
