PARP1-Inhibitor BSI-201 neuer Hoffnungsträger
Der Poly(ADP-Ribose)-Polymerase-Inhibitor (PARP)-Inhibitor BSI-201 ist ein neuartiger experimenteller Wirkstoff, der die Effektivität zytotoxischer Agentien insofern verstärken kann, als er die Zellen an der Reparatur von DNA-Schäden hindert.
Vielversprechende Phase-II-Studienergebnisse (siehe auch topgynonko Juli 2009)
In der klinischen Phase-II-Prüfung wurden 116 Patientinnen mit metastasiertem, dreifach negativem Brustkrebs (definiert als ER/PR< 10% und Her2 als 1) FISH negativ oder 2) IHC 2+/3+ und FISH negativ oder 3) IHC 0/1+)randomisiert mit BSI-201 in Kombination mit Gemcitabin und Carboplatin (GC) oder nur mit GC behandelt. Für diejenigen Patientinnen, die eine Chemotherapie ohne BSI-201 erhielten, war bei Einsetzen einer Krankheitsprogression die Umstellung auf den PARP-Inhibitor zulässig.
Der klinische Nutzen – definiert als vollständige oder partielle Remission oder eine stabile Krankheit für die Dauer von mindestens sechs Monaten – war in der Gruppe der mit BSI-201 behandelten hochsignifikant größer als in der Gruppe ohne BSI-201 (62% vs. 21%; p=0,0002). Beim Vergleich der Ansprechraten (vollständig und partiell) betrug das Verhältnis 48% zu 16% zugunsten der mit BSI-201 behandelten Gruppe. Die Frauen dieser Gruppe hatten zudem das signifikant bessere progressionsfreie Überleben wie auch Gesamtüberleben mit 6,9 Monaten bzw. 12,2 Monaten im Vergleich 3,3 Monaten bzw. 7,7 Monaten bei den Frauen, die nur die Chemotherapie erhalten haben (Abb.).
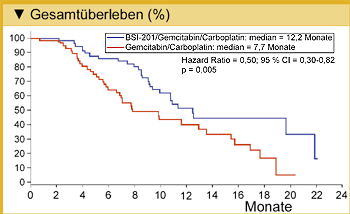
| |
| Phase-II-Studie mit BSI-201: Gesamtüberleben in der Intention-to-Treat-Population (nach O´Shaughnessy J, et al. SABCS 2009 Abstract 3122). |
Als häufigste schwere Nebenwirkungen vom Grad 3 und 4 traten Neutropenie (25 von 57 Patientinnen bei Behandlung mit GC plus
BSI-201 und bei 31 von 59 Patientinnen bei Behandlung mit GC alleine). Ferner wurden Thrombozytopenie und Anämie Grad 3/4 beobachtet.
Durch die zusätzliche Gabe von BSI-201 nahmen weder Häufigkeit noch Schweregrad der mit der Chemotherapie assoziierten
Nebenwirkungen zu.
Fortschritte in der klinischen Entwicklung von BSI-201
Der klinische Entwicklungsprozess des PARP1-Inhibitors BSI-201 zur Behandlung von metastasiertem, dreifach negativem Brustkrebs schreitet planmäßig voran. Aufgrund des sich abzeichnenden hohen Potentials der Substanz in der Therapie einer schwerwiegenden Krankheit wurde dem Wirkstoff BSI-201 von der US-amerikanischen Food and Drug Administration (FDA) inzwischen ein beschleunigtes Prüfverfahren bewilligt.
Im Juli 2009 begann in den USA eine multizentrische Phase-III-Studie zur Untersuchung der Wirksamkeit und Verträglichkeit von
BSI-201 in Kombination mit GC bei Patientinnen, die im metastasierten Stadium bereits 0 bis 2 Therapien hinter sich haben. Sie
erhalten in randomisierter Weise GC mit oder ohne BSI-201. mk
Quelle: Fachpresse-Hintergrundgespräch: “Das Triple Negative Mammakarzinom: Herausforderungen und neue Hoffnungsträger”
am 17. Juni 2010 in München. Veranstalter: Sanofi-Aventis Deutschland GmbH.
Druckversion (pdf)
BSI-201 hemmt die enzymatische Reparatur von DNA-Schäden
Phase-II Studie:
Klinischer Nutzen bei 62% mit BSI-201 und 21% ohne BSI-201
Gesamtüberleben 9,2 Monate gegenüber 5,7 Monate bei Behandlung mit bzw. ohne BSI-201
Nebenwirkungsspektrum von Chemotherapie durch BSI-201 nicht erschwert
Klinischer Entwicklungsprozess von BSI-201 schreitet planmäßig voran
FDA bewilligt beschleunigtes Prüfverfahren