Medizinische Bildgebung: Biosensor Zymonsäure zeigt pH-Wert-Veränderungen
Bei Tumoren, Entzündungen und Durchblutungsstörungen gerät der Säure-Basen-Haushalt des Körpers lokal aus dem Gleichgewicht. Diese Veränderungen des pH-Werts ließen sich etwa für die Erfolgskontrolle von Krebsbehandlungen nutzen. Bisher fehlt aber eine Bildgebungsmethode, um sie in Patienten sichtbar zu machen. Ein Team der Technischen Universität München (TUM) hat jetzt einen pH-Sensor entwickelt, der mittels Magnetresonanztomographie (MRT) den pH-Wert abbildet – nicht-invasiv und ohne Strahlenbelastung.
Bei einem Magnetresonanz-Experiment mit Tumorzellen fand Dr. Franz Schilling,
Physiker an der TUM, vor vier Jahren Signale eines Moleküls, das sehr empfindlich
auf pH-Veränderungen reagiert. Dieser Stoff – Zymonsäure, wie sich in weiteren
Untersuchungen herausstellte – könnte in Zukunft für die medizinische Bildgebung
eine wichtige Rolle spielen. Als Biosensor für pH-Werte könnte das Molekül Einblicke
in den Körper eröffnen, die so bislang nicht möglich waren.
„Mit einer geeigneten pH-Wert-Bildgebung könnte man krankhafte Veränderungen
des Gewebes und insbesondere Stoffwechselprozesse von Tumoren sichtbar machen“,
erläutert Franz Schilling. Die Umgebung von Tumoren und Entzündungen ist meist
etwas saurer als die von gesundem Gewebe und wird in Zusammenhang mit der Aggressivität
von Tumoren gebracht. Auch für die Prognose von Behandlungen sieht Schilling Perspektiven:
„pH-Werte sind auch interessant, wenn es darum geht, die Wirksamkeit von Tumorbehandlungen
zu beurteilen. Noch bevor ein erfolgreich behandelter Tumor kleiner wird, könnte sich
sein Stoffwechsel und damit der pH-Wert seiner Umgebung ändern. Durch eine geeignete
pH-Bildgebungsmethode wüsste man viel früher, ob man den richtigen Ansatz gewählt hat.“
Schilling leitet mittlerweile die Arbeitsgruppe für Präklinische Bildgebung und
Medizinische Physik an der Klinik und Poliklinik für Nuklearmedizin des Klinikums
rechts der Isar der TUM. Gemeinsam mit Kolleginnen und Kollegen aus Physik, Chemie
und Medizin hat er in den vergangenen Jahren an Zymonsäure als Biosensor geforscht.
Im Fachmagazin „Nature Communications“ beschreibt das Team, wie damit pH-Werte im
Körper von Kleintieren zuverlässig dargestellt werden können.
MRT-Untersuchung unter Zeitdruck
Um pH-Werte mithilfe von Zymonsäure sichtbar zu machen, wird das Molekül in den Körper
injiziert und dann eine Magnetresonanztomographie (MRT) des zu untersuchenden Gewebes
erstellt. Sehr vereinfacht gesagt, werden dabei in einem starken Magnetfeld die Kernspins
der Zymonsäure mit Radiowellen zu Schwingungen angeregt. Die Reaktion der Kerne wird
anschließend aufgezeichnet. Aus diesen Daten errechnet man Frequenzspektren, die
wiederum Aufschluss über die chemischen Eigenschaften der molekularen Umgebung der
Kerne geben. Anhand von pH-abhängigen molekularen Veränderungen der Zymonsäure lässt
sich schließlich der pH-Wert an jedem untersuchten Punkt des Gewebes darstellen.
Damit sie auf MRT-Aufnahmen sichtbar wird, muss die Zymonsäure mit Kohlenstoff 13
markiert werden. Das bedeutet, dass die Moleküle anstelle der „normalen“ Kohlenstoff
12-Atome Kohlenstoff 13-Atome (13C) enthalten. Doch auch auf diese Weise markierte
Zymonsäure ist noch nicht messbar – ihr MRT-Signal ist zu schwach. „Wir nutzen
deswegen ein relativ neues Verfahren, die Hyperpolarisation“, erläutert Stephan Düwel,
Physiker und Erstautor der Studie. „Dabei übertragen wir mit einem speziellen Gerät
bei sehr niedrigen Temperaturen mit Hilfe von Mikrowellen die Polarisation von
Elektronen auf die 13C-Atomkerne und verstärken dadurch das MRT-Signal bis zu
100.000-fach.“ Die Zymonsäure wird dann mithilfe heißer Flüssigkeit in kurzer Zeit
wieder auf Raumtemperatur gebracht.
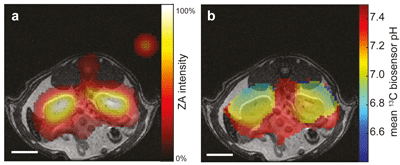
Abb.: Messungen mit hyperpolarisierter Zymonsäure in den Nieren einer Ratte.
Überlagerung von hyperpolarisierten 13C-Messungen (in Farbe) mit anatomischen
Protonenbildern (in Graustufen) zeigen die Akkumulation von Zymonsäure in den
Nieren (a) und niedrigere pH-Werte in der Niere im Vergleich zum umliegenden Gewebe (b).
Dann muss alles sehr schnell gehen: Der Biosensor wird intravenös in den zu
untersuchenden Organismus gespritzt. Für die Aufnahme mit dem MRT-Gerät bleiben
gerade einmal 60 Sekunden, bevor der signalverstärkende Effekt durch die
Hyperpolarisation wieder abgeklungen ist. „Wir arbeiten derzeit daran, dieses
Zeitfenster zu vergrößern“, sagt Düwel. „Dabei versuchen wir zum einen, die
MRT-Eigenschaften von Zymonsäure durch geeignete Veränderungen an dem Molekül
zu verbessern, und zum anderen, weitere pH-sensitive Moleküle zu finden“,
erläutert der Biochemiker Christian Hundshammer, Zweitautor der Studie.
Vorteile gegenüber anderen Ansätzen
Franz Schilling und sein Team konnten zeigen, dass ihre Methode empfindlich
genug ist, um medizinisch relevante Veränderungen des pH-Wertes im Organismus
abzubilden. Mit Zymonsäure lässt sich außerdem gezielt der pH-Wert außerhalb der
Zellmembran untersuchen, während bei anderen Biosensoren unklar ist, ob gemessene
Veränderungen innerhalb oder außerhalb der Zelle (intrazellulär oder extrazellulär)
stattfinden. Das ist wichtig, da der intrazelluläre Wert üblicherweise stabil ist,
während der extrazelluläre viel stärker von Stoffwechselveränderungen beeinflusst wird.
Anders als bei optischen Verfahren, die aufgrund der geringen Lichtdurchlässigkeit
von Gewebe nur oberflächlich in den Körper eindringen können, gibt es bei der MRT
keine Begrenzungen bezüglich der Eindringtiefe. Zudem wurde gezeigt, dass Zymonsäure
in den in Kleintieren verwendeten Konzentrationen ungiftig ist und auch in geringen
Konzentrationen als Nebenprodukt des im Körper vorhandenen Stoffwechselprodukts
Brenztraubensäure entsteht.
„Wir glauben, dass Zymonsäure ein vielversprechender Biosensor für die Anwendung
bei Patienten ist“, sagt Franz Schilling. Zunächst sind allerdings weitere präklinische
Studien geplant, um die Vorteile dieses neuen bildgebenden Biomarkers gegenüber
konventionellen Verfahren herauszustellen und die räumliche Auflösung der pH-Bildgebung
weiter zu verbessern.
Die Forschungsarbeiten werden im Rahmen des SFB824 „Bildgebung zur Selektion,
Überwachung und Individualisierung der Krebstherapie“ unter der Leitung von
Prof. Markus Schwaiger durchgeführt.
Publikationen:
Düwel S, Hundshammer C, Gersch M, Feuerecker B, Steiger K, et al. 2017.
"Imaging of pH in vivo using hyperpolarized 13C-labeled zymonic acid".
Nature Communications (2017). doi: 10.1038/ncomms15126
Schilling F, Düwel S, Köllisch U, Durst M, Schulte RF, et al. 2012.
"Diffusion of hyperpolarized 13C-metabolites in tumor cell spheroids using
real-time NMR spectroscopy". NMR Biomed. 26:557–568. doi:10.1002/nbm.2892
http://onlinelibrary.wiley.com/doi/10.1002/nbm.2892/abstract
Quelle: Technische Universität München
Kontakt:
Dr. rer. nat. Franz Schilling
Klinik und Poliklinik für Nuklearmedizin
Klinikum rechts der Isar
Technische Universität München
E-Mail: fschilling@tum.de
| Mai 2017 |
 Inhalt
InhaltVulväre intraepitheliale Neoplasie
Präinvasive genitale Läsionen mit erheblich ange stiegener Inzidenzrate
Literaturreferate
GeparQuattro-Studie:
Neoadjuvante Therapie mit Trastuzu-
Capecitabin zu Anthrazyklin- und Taxan-basierter neoadjuvanter Therapie bei primärem Brustkrebs
Paclitaxel dosisdicht bei fortgeschrittenem Ovarialkrebs
