|
| |||||
|
Typ I umfasst endometroide, muzinöse, Klarzell- und gut differenzierte mikropapilläre, seröse Karzinome, die vorwiegend
in der ovariellen Rindenzone entdeckt werden, häufig auf eine oder zwei Zysten beschränkt sind, und deren Entwicklung oft
„gemächlich“ stufenweise aus gut charakterisierten Vorstufen von benigne zu maligne voranschreitet. Diese Tumoren zeichnen
sich durch relative genetische Stabilität aus. Definierte Mutationen treten in bestimmten Onkogenen und Tumorsuppressor-
Zu Typ II zählen mäßig und schlecht differenzierte seröse Karzinome, von denen die meisten auf der ovariellen Oberfläche
entdeckt werden, und bei denen häufig die Tuben, die Mesenterien und das Omentum involviert sind. Ferner gehören auch
maligne gemischte mesodermale Tumoren und undifferenzierte Karzinome in die Gruppe der Typ-II-Tumoren. Kennzeichnend für
diese Tumoren sind Auftauchen „wie aus dem Nichts“, rasantes Wachstum, p53-Mutationen und genetische Instabilität.
Die Propagierung eines zweistufigen Systems für Ovarialkarzinome, das nur noch zwischen gut und schlecht differenzierten Tumoren
unterscheidet – wie es bereits Malpica et al. (2004) anhand der Bewertung zytologischer Atypien für ausschließlich seröse Ovarialkarzinome
angeregt hatten [3] – wird auch durch Untersuchungen von Vang et al. (2008) unterstützt. Deren Ergebnisse legen nahe, dass die
traditionelle Untergruppierung in mäßig (G2) und schlecht differenzierte (G3) Tumoren biologisch nicht valide ist. Es ließen sich keine
signifikanten Unterschiede bezüglich Häufigkeit von Mutationen im Tumorsuppressor-Gen p53 und extremer Chemoresistenz (extreme drug
resistance = EDR) feststellen [4]. Im Gegensatz dazu haben gut differenzierte mikropapilläre seröse Karzinome unterschiedliche
molekulargenetische und klinische Merkmale sowie differente EDR-Profile, was die Einstufung als eigenständige Tumorentitäten
rechtfertigt [5].
Verschiedene genetische Faktoren der endometroiden, Klarzell- und mukösen Tumoren sind in Tabelle 1
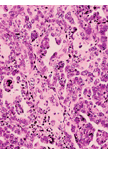
Seröse Karzinome vom Typ I entstehen im Ovar. Es finden sich zumeist K-ras- und andere Mutationen, nicht aber Mutationen im Tumorsuppressor-Gen p53. Der Tumor besteht aus einer Mischung von Zellen mit sekretorischen und ziliaren Differenzierungsmerkmalen. Im Gegensatz dazu sind in serösen Karzinomen vom Typ-II p53-Mutationen regelmäßig nachgewiesen worden. Die Angaben hierzu schwanken zwischen 50 % und 80 %. Den höchsten Anteil an p53-Mutationen identifizierten jüngst Salani et al. (2008) mit 80,3 % in DNA-Proben aus affinitätsgereinigten Zellen von 71 hochgradigen serösen Ovarialkarzinomen [8]. Sie fanden darüber hinaus, dass p53 nicht direkt in die Entwicklung von Chemoresistenz involviert ist. Bei der Suche nach initialen Ereignissen in der Karzinogenese von schlecht differenzierten serösen Tumoren ist man auf einen Prozess gestoßen, der als p53-Signatur bezeichnet wird. Dessen Merkmale sind [7]:
Die frühesten erkennbaren neoplastischen Veränderungen wurden auch in intraepithelialen Tubenkarzinomen beschrieben. Sie zeigen
sekretorische oder undifferenzierte Zellen ohne Zilien, d.h. im Gegensatz zu gut differenzierten serösen Tumoren sind die schlecht
differenzierten Tumoren dadurch gekennzeichnet, dass ihnen die Fähigkeit zur Ausdifferenzierung in Zilien-tragende Zellen verloren
gegangen ist.
 Letzteres können intraepitheliale Karzinome oder prädisponierende Veränderungen wie endometroide Zysten, Zystadenome und
Borderlinetumoren sein.
Letzteres können intraepitheliale Karzinome oder prädisponierende Veränderungen wie endometroide Zysten, Zystadenome und
Borderlinetumoren sein. Intraepitheliale Karzinome bei serösen ovariellen und peritonealen Tumoren wurden selten identifiziert. Das ist zumindest ein indirektes Indiz dafür, dass Ovarialkarzinome ihren Ursprung gar nicht in den Ovarien haben, sondern sich unter Umständen primär in der distalen Tube entwickeln. Bestätigt sich das, sind unter Umständen dramatische Veränderungen in den wissenschaftlichen Fragestellungen sowie auch im klinischen Umgang mit dieser Krankheit zu erwarten.
In den letzten Jahren nahm die Forschungsaktivität auf dem Gebiet der serösen Karzinogenese wieder richtig Fahrt auf, wobei
insbesondere Indizien für die Entstehung von Ovarialkrebs auch in der Tube angehäuft wurden (Tabelle 3) [10-15]. Ferner impliziert
Es gibt eine Reihe von Gründen, die es wichtig erscheinen lassen, Klarheit über die Ursprungsorte und den Entwicklungsgang pelviner seröser Karzinome zu schaffen [10]: (1) Ihre Aufklärung ist Voraussetzung für mögliche Strategien zur Prävention und frühen Entdeckung von Ovarialkrebs. (2) Prophylaktische operative Eingriffe bei Trägerinnen von Mutationen in Suszeptibilitätsgenen (BRCA1, BRCA2) sollten sich auf die Gewebe mit dem höchsten malignen Entartungsrisiko konzentrieren. (3) Eine gezielte Probenentnahme für histopathologische Untersuchungen erfordert die genaue Kenntnis der Risikogewebe. (4) Erst wenn das Gebiet mit dem höchsten Entartungsrisiko identifiziert ist, lassen sich für den Ursprungsort realistische Inzidenzraten ermitteln. Kindelberger et al. (2007) analysierten die Beziehung zwischen intraepithelialen (nicht-invasiven) Tubenkarzinomen und pelvinen serösen Karzinomen. Sie untersuchten nach Salpingo-Oophorektomien die komplette Adnexe – insbesondere aber die Fimbrien – nach einem strengen Protokoll. In 41 Fällen, von denen fünf als Tuben-, sechs als peritoneale und 30 als Ovarialkarzinome klassifiziert wurden, ließen sich auch intraepitheliale Tubenkarzinome nachweisen. Fünf der intraepithelialen Tubenkarzinome und Ovarialkarzinome derselben Adnexe enthielten identische p53-Mutationen. Die Autoren folgern, dass intraepitheliale Neoplasien in der Tube ein plausibler Ursprung sowohl von von Tuben-. peritonealen als auch Ovarialkarzinomen sind [13].
Salvador et al. (2008) wiesen chromosomale Instabilität in tubaren Vorläufer-Läsionen von serösen Karzinomen nach. Zudem berichteten
sie, dass Karzinome der tubaren Mukosa und Ovarialtumoren in den meisten Fällen ähnliche genetische Anomalien aufweisen. Das deutet
auf einen monoklonalen Ursprung entweder in den Ovarien, dem Peritoneum oder den Tuben hin [16].
Das ovarielle Oberflächenepithel auf den nicht ovulierenden Eierstöcken ist ein ortsgebundenes Mesothel, das sowohl
epitheliale als auch mesenchymale Merkmale aufweist. Dementsprechend hat es die Fähigkeit beibehalten, sich in Richtung
eines stromalen Phänotyps zu differenzieren. Das erfolgt als Reaktion auf Stimuli wie Ruptur (Ovulation) oder Explantation
(Gewebekultur), die regenerative (Reparatur)-Prozesse auslösen. Andererseits ist das ovarielle Oberflächenepithel in der
Lage, komplexe epitheliale Merkmale auszuformen, wie sie den sich von den Müller-
Tubare Metaplasien des ovariellen Oberflächenepithels lassen sich morphologisch anhand der hochzylindrischen Gestalt
und Zilien als Oberflächendifferenzierung sowie histochemisch anhand der Expression von E-Cadherin, CA-125 und dem
Ovidukt-
Menschliches ovarielles Oberflächenepithel bildet in vitro bei einer Behandlung mit karzinogenen Substanzen maligne,
ovariellen Karzinomen ähnelnde Tumoren [21]. Ob die neoplastische Transformation auch in vivo direkt aus ovariellem
Oberflächenepithel hervorgehen kann, ist letztlich nicht geklärt. Denn in vivo werden metaplastische Veränderungen des
ovariellen Oberflächenepithels hauptsächlich in Inklusionszysten und in Invaginationen (Krypten) vorgefunden. Letztete
können sich von der Oberfläche abschnürende Zysten sein.
Die Häufigkeit, mit der frühe Tubenkarzinome im Rahmen einer prophylaktischen Salpingo-Oophorektomie vorgefunden wurden, variiert in verschiedenen Studien, in denen das Gewebematerial allerdings zum Teil auch unterschiedlich rigoros untersucht worden ist. Insgesamt wird der Tube bei BRCA-Mutation-positiven Frauen ein größeres Risiko für die Entwicklung von serösem Krebs zugeschrieben als den Ovarien. Medeiros et al. (2006) identifizierten die Fimbrien als häufigsten Ort früher seröser Karzinome in einer kleinen Serie von Gewebeproben aus prophylaktischen Salpingo-Oophorektomien bei BRCA-Mutation-positiven Patientinnen. Von 13 operierten Frauen wiesen vier die Neoplasien im Epithel der Fimbrien und eine in dem der Ampulla auf. In keinem Fall waren die Ovarien betroffen [10].
Powell et al. (2005) fanden auf Serienschnitten von Ovarien und Tuben in sieben von 67 prophylaktischen Salpingo-
Im Gegensatz dazu fanden Finch et al. (2006a) bei 490 prophylaktischen Salpingo-Oophorektomien elf okkulte Fälle (2,2%)
von Krebs, von denen sieben im Ovar lokalisiert waren [24].
Finch et al. (2006b) entdeckten bei der pathohistologischen Untersuchung der Adnexe nach 159 Salpingo-Oophorektomien bei BRCA1-
und BRCA2-Mutation positiven Frauen sieben okkulte Karzinome (4,4 %). Drei davon betrafen die Tube und nicht die Ovarien [12].
Auch Callahan et al. (2007) halten die distale Tube für den hauptsächlichen Entstehungsort schlecht differenzierter seröser Tumoren.
Sie entdeckten okkulte Neoplasien bei 5,7 % der Frauen (n=122), die sich einer Operation zur Risikoreduktion von Ovarialkrebs
unterzogen hatten [25].
Aufgrund der identischen Histologie von peritonealen und hochgradigen serösen Ovarialkarzinomen ist vielfach eine Unterscheidung
von Primärtumor und Metastase schwer zu treffen. In Fällen massiver Tumorlast im Peritoneum, dem Omentum und den Mesenterien bei
nur geringer Beteiligung der Ovarien liegt der Verdacht nahe, dass sich ein peritoneales Karzinom auf den Ovarien abgesiedelt hat.
Nach den Ergebnissen einer prospektiven Studie von Finch et al. (2006) haben Frauen mit einer Mutation im BRCA1- oder BRCA2-Gen,
die sich prophylaktisch einer bilateralen Salpingo-Oophorektomie unterziehen, ein kumulatives Risiko für ein primäres peritoneales
Karzinom von 4,3 % [24]. Es wurden insgesamt sieben Fälle registriert, die im Mittel fünf Jahre nach der Salpingo-Oophorektomie
auftraten. Allerdings wurden drei der peritonealen Karzinome bereits innerhalb von nur drei Jahren diagnostiziert, so dass nicht
ausgeschlossen werden kann, dass es sich um Metastasen einer zum Zeitpunkt der Salpingo-Oophorektomie übersehenen subklinischen
Krankheit handelte. Das hätte zur Folge, dass das Risiko für primäre peritoneale Karzinome unter Umständen doch geringer wäre.
Im frühest erkennbaren Entwicklungsstadium (Primordium) bilden das ovarielle Oberflächenepithel und andere sich vom Zölomepithel (Müller-Epithel) ableitende Gewebe ein nicht determiniertes, multipotentes, embryonales Feld. Als Reaktion auf spezifische, induktive Signale erfolgt die eindeutige Determinierung des Eileiterepithels, des Endometriums und des Zervikalepithels. Das ovarielle Oberflächenepithel verbleibt hingegen in einem primitiveren, multipotenten Zustand – vermutlich aufgrund fehlender Induktionssignale auf einer entscheidenden Stufe der Embryonalentwicklung. Während also das extraovarielle Peritoneum und das Epithel der Ampulla bei der erwachsenen Frau voll ausdifferenziert zu sein scheinen, verbleiben das ovarielle Oberflächenepithel und das mit ihm verbundene Epithel der distalen Fimbrien auf einer nicht voll determinierten Entwicklungsstufe. Histochemische Vergleiche zwischen ovariellem Oberflächenepithel, Fimbrien und Ampulla lassen einen klaren Übergang vom ovariellen Oberflächenepithel auf das Epithel der Fimbrien erkennen, das aber bezüglich der Differenzierung ohne scharfe Grenzen verläuft. Übergänge bei der Expression von Markern wie Calretinin, einem Vitamin-D-anhängigen Kalzium-bindenden Protein, finden sich sowohl auf dem ovariellen Oberflächenepithel als auch auf den Fimbrien. Ähnliche Verschiebungen sind auch für E-Cadherin nachgewiesen.
Die Autoren verweisen darauf, dass Übergangsbereiche von einer Epithelart in eine andere – wie beispielsweise von Platten- in
Säulenepithel in der zerviko-uterinen Region – verstärkt zu neoplastischer Transformation neigen.
Literatur: [1] Kurman RJ, Visvanathan K, Roden R, et al. 2008. Early detection and treatment of ovarian cancer: shifting from early stage to minimal volume of disease based on a new model of carcinogenesis. Am J Obstet Gynecol 198:351-356. Burger RA, 2008. Editorial: A new model of ovarian carcinogenesis may influence early detection strategies. Am J Obstet Gynecol 198:35349-350. [2] Crum CP, Drapkin R, Miron A, et al. 2007. The distal fallopian tube: a new model for pelvic serous carcinogenesis. Curr Opin Obstet Gynecol 19:3-9. [3] Malpica A, Deavers MT, Lu K, et al. 2004. Grading ovarian serous carcinoma using a two-tier system. Am J Surg Pathol 28:496–504. [4] Vang R, Shih I-M, Salani R, et al. 2004. Subdividing ovarian and peritoneal serous carcinoma into moderately differentiated and poorly differentiated does not have biologic validity based on molecular genetic and in vitro drug resistance data. Am J Surg Pathol 32:1667-1674. [5] Santillan A, Kim YW, Zahurak ML, et al. 2007. Differences of chemoresistance assay between invasive micropapillary/low-grade serous ovarian carcinoma and high-grade serous ovarian carcinoma. Int J Gynecol Cancer 17:601-606. [6] Farley J, Ozbun LL, Birrer MJ, 2008. Genomic analysis of epithelial ovarian cancer. Cell Research 18:538-548. [7] Jarboe EA, Folkins AK, Drapkin R, et al. 2008. Tubal and ovarian pathways to pelvic epithelial cancer: a pathological perspective. Histopathology 53:127-138. [8] Salani R, Kurman RJ, Giuntoli R, II, et al. 2008. Assessment of TP53 mutation using purified tissue samples of ovarian serous carcinomas reveals a higher mutation rate than previously reported and does not correlate with drug resistance. Int J Gynecol Cancer 18:487-491. [9] Folkins AK, Jarboe EA Saleemuddin A, et al. 2008. A candidate precursor to pelvic serous cancer (p53 signature) and its prevalence in ovaries and fallopian tubes from women with BRCA mutations. Gynecol Oncol 109:168-173. [10] Medeiros F, Muto MG, Lee Y, et al. 2006. The tubal fimbria is a preferred site for early adenocarcinoma in women with familial ovarian cancer syndrome. Am J Surg Pathol 30:230-236. [11] Piek JM, Kenemans P, Verheijen RH, 2004. Intraperitoneal serous adenocarcinoma: a critical appraisal of three hypotheses on its cause. Am J Obstet Gynecol 191:718-732. [12] Finch A, Shaw P, Rosen B, et al. 2006. Clinical and pathologic findings of prophylactic salpingo-oophorectomies in 159 BRCA1 and BRCA2 carriers. Gynecol Oncol 100:58-64. [13] Kindelberger DW, Lee Y, Miron A, et al. 2007. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: evidence for a causal relationship. Am J Surg Pathol 31:161-169. [14] Cass I, Holschneider C, Datta N, et al. 2005. BRCA-mutation-associated fallopian tube carcinoma: a distinct clinical phenotype? Obstet Gynecol 106:1327-1334. [15] Lee Y, Madeiros F, Kindelberger D, et al. 2006. Advances in the recognition of tubal intraepithelial carcinoma: applications to cancer screening and the pathogenesis of ovarian cancer. Adv Anat Pathol 13:1-7. [16] Salvador S, Rempel A, Soslow WA, et al. 2008. Chromosomal instability in fallopian tube precursor lesions of serous carcinoma and frequent monoclonality of synchronous ovarian and fallopian tube mucosal serous carcinoma. Gynecol Oncol 110:408-417. [17] Jordan SJ, Green AC, Whitman DC, et al. and the Australian Ovarian Cancer Study Group. 2008. Serous ovarian, fallopian tube and primary peritoneal cancers: a comparative epidemiological analysis. Int J Cancer 122:1598-1603. [18] Flavin RJ, Smyth PC, Laios A, et al. 2008. Potentially important microRNA cluster on chromosome 17p13.1 in primary peritoneal carcinoma. Mod Pathol doi:10.1038/modpathol.2008.135 [19] Auersperg N, Wong AST, Choi K-C, et al. 2001. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev 22:255-288. [20] Woo MM, Gilks CB, Verhage HG, et al. 2004. Oviductal glycoprotein, a new differentiation-based indicator present in early ovarian epithelial neoplasia and cortical inclusion cysts. Gynecol Oncol 93:315-319. [21] Liu J, Yang G, Thompson-Lanza JA, et al. 2004. A genetically defined model for human ovarian cancer. Cancer Res 64:1655-1663. [22] Piek JM, van Diest PJ, Zweemer RP, et al. 2001. Dysplastic changes in prophylactically removed fallopian tubes of women predisposed to developing ovarian cancer. J Pathol 195:451-456. [23] Powell CB, Kenley E, Chen L-m, et al. 2005. Risk-reducing salpingo-oophorectomy in BRCA mutation carriers: role of serial sectioning in the detection of occult malignancy. J Clin Oncol 23:127-132. [24] Finch A, Beiner M, Lubinski J, et al. for the Hereditary Ovarian Cancer Clinical Study Group. 2006. Salpingo-oophorectomy and the risk of ovarian, fallopian tube, and peritoneal cancers in women with BRCA1 or BRCA2 mutation. JAMA 296:185-192. [25] Callahan MJ, Crum CP, Medeiros F, et al. 2007. Primary fallopian tube malignancies in BRCA-positive women undergoing surgery for ovarian cancer risk reduction. J Clin Oncol 25:3985-3990. [26] Auersperg N, Woo MMM, Gilks CB, 2008. Letter to the Editor. The origin of ovarian carcinomas: A developmental view. Gynecol Oncol 110:452-454. | |||||
|
Epitheliale Ovarialkarzinome – Wo haben sie ihren Ursprung und was ist der erste Schritt in der Tumorigenese? Schlüsselwörter: Epitheliale Ovarialkarzinome, epithelialer Ovarialkrebs |
|||||
| |||||
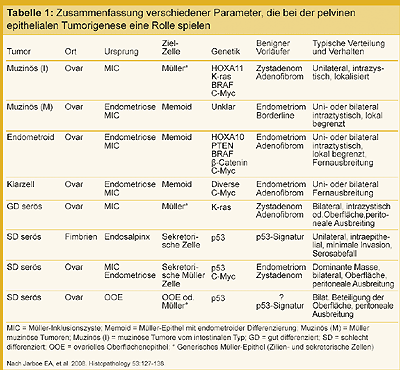 aufgeführt [7].
Vielfach kommt Mikrosatelliteninstabilität hinzu. Allerdings nehmen die unter Typ I aufgeführten relativ seltenen
Klarzellkarzinome eine Sonderstellung ein. Sie stehen zwar häufig im Zusammenhang mit Vorläufer-Läsionen wie Endometriose
und Klarzell-Borderlinetumoren und weisen auch keinen hohen Grad an genetischer Instabilität auf, doch sie sind fast
immer schlecht differenziert, so dass sie eigentlich weder richtig zu Typ I noch zu Typ II gehören.
aufgeführt [7].
Vielfach kommt Mikrosatelliteninstabilität hinzu. Allerdings nehmen die unter Typ I aufgeführten relativ seltenen
Klarzellkarzinome eine Sonderstellung ein. Sie stehen zwar häufig im Zusammenhang mit Vorläufer-Läsionen wie Endometriose
und Klarzell-Borderlinetumoren und weisen auch keinen hohen Grad an genetischer Instabilität auf, doch sie sind fast
immer schlecht differenziert, so dass sie eigentlich weder richtig zu Typ I noch zu Typ II gehören. die Lokalisation schlecht differenzierter seröser Karzinome in Ovar, Tube und Peritoneum mit zahlreichen auffälligen klinischen
und molekulargenetischen Übereinstimmungen, dass es sich um Varianten derselben Tumorentität handeln könnte. Am wenigsten ist
bislang die Einbeziehung der peritonealen Karzinome gesichert. Allerdings kommen „Müller“-Inklusionen in Form von Endosalpingiose
und Endometriose auch im Peritoneum häufig vor.
die Lokalisation schlecht differenzierter seröser Karzinome in Ovar, Tube und Peritoneum mit zahlreichen auffälligen klinischen
und molekulargenetischen Übereinstimmungen, dass es sich um Varianten derselben Tumorentität handeln könnte. Am wenigsten ist
bislang die Einbeziehung der peritonealen Karzinome gesichert. Allerdings kommen „Müller“-Inklusionen in Form von Endosalpingiose
und Endometriose auch im Peritoneum häufig vor.