|
Tieferes Verständnis der Tumorbiologie als Wegbereiter neuer Therapieoptionen? | ||||||
|
Angaben zur Prävalenz von dreifach rezeptornegativem Brustkrebs variieren von 10 % bis 17 %. Diese Differenzen
basieren hauptsächlich auf unterschiedlichen Schwellenwerten, die jeweils für die Eingruppierung als
Hormonrezeptor-
Dreifach rezeptornegative Brusttumoren stellen eine sehr aggressive Krebsform dar. Häufig sind jüngere Frauen unter
50 Jahren betroffen, und Studien aus den USA zeigen, dass hierunter prämenopausale Afroamerikanerinnen deutlich
überrepräsentiert sind. In der Mehrheit der Fälle von dreifach rezeptornegativem Brustkrebs finden sich Tumorzellen
mit dem histologischen Grad 3, obgleich bei etwa jeder zehnten betroffenen Frau auch nur der Tumorgrad 1 registriert
wird. Brustkrebs bei Frauen mit einer BRCA1-Mutation ist zumeist dreifach rezeptornegativ.
Der deutlichste Unterschied im Gesamtprofil der Genexpression wird zwischen ER-positiven und ER-negativen Tumoren beobachtet [1, 2]. Bei ersteren werden anhand der Genexpressionsprofile zwei Subtypen, luminal A und B, unterschieden. In ähnlicher Weise lassen sich ER-negative Tumoren in drei weitere molekulare Subtypen untergliedern: normaler brustähnlicher, ERBB2 -positiver und basalähnlicher Typ. Als basalähnliche Mammakarzinome werden Tumoren bezeichnet, deren neoplastische Zellen durchweg Gene exprimieren, wie das auch in basalen/myoepithelialen Brustzellen der Fall ist. Hierzu zählen hochmolekulare Zytokeratine (ZK; ZK5/6, 14, 17), Vimentin, p-Cadherin, B-Krystallin, Fascin sowie die Caveoline 1/2 sowie verschiedene myoepitheliale Marker. Der basalähnliche Phänotyp war im Grunde bereits vor der molekulargenetischen Ära anhand des immunhistochemischen Nachweises von Zytokeratinen in Brusttumoren erkannt worden [4], geriet jedoch wieder weitgehend in Vergessenheit. Zu einem sehr hohen Prozentsatz werden in solchen Tumoren verschiedene mit der Proliferation im Zusammenhang stehende Gene überreichlich exprimiert. In bis zu 85 % der basalähnlichen Karzinome lässt sich entweder p53 immunhistochemisch nachweisen oder es finden sich p53-Genmutationen.
Basalähnliche Mammakarzinome weisen in ihren klinischen und Tumorcharakteristika große Übereinstimmung mit dreifach
rezeptornegativen Brusttumoren auf. Es handelt sich überwiegend um aggressive Tumoren. Die weitgehende Übereinstimmung
hat dazu geführt, dass beide Begriffe vielfach synonym verwendet werden.
den Immunglobulin-Cluster, den Interferon-Cluster, den Ionentransporter-Cluster und den Proliferationscluster, doch aus ihnen ließen sich keine schlüssigen biologischen Mechanismen für die Subklassifizierung der Tumoren ableiten [5]. Die meisten anderen Untersucher unterscheiden zwischen dreifach rezeptornegativen und basalähnlichen Tumoren [Reviews 6 - 8]. Sie machen deutlich, dass beide Klassifizierungen zwar zahlreiche klinische und pathologische Gemeinsamkeiten aufweisen, sie jedoch aufgrund ihrer unterschiedlichen Definitionen keineswegs identisch sind. Andererseits wurde in praktisch allen einschlägigen Untersuchungen festgestellt, dass der größte Teil basalähnlicher Tumoren zugleich dreifach rezeptornegativ ist und vice versa. Dennoch stimmen beide Kategorien zu einem erheblichen Prozentsatz nicht überein. Bertucci et al. (2008) analysierten die Genexpressionsprofile von 172 immunhistochemisch als dreifach rezeptornegativ klassifizierten Mammakarzinomen. Als basalähnlich stellten sich 123 Tumoren (71 %) heraus. Die restlichen 49 Fälle verteilten sich auf luminal A (8), luminal B (4), ERBB2-überexprimierend (12), normal brustartig (15) und zu keinem Subtyp passend (10). Demnach bestanden in ca. 30 % der Fälle Diskrepanzen zwischen der immunhistochemischen Einstufung und dem anhand von Microarray-Analysen bestimmten molekularen Phänotyp. Von den basalähnlichen Tumoren hatten 88 % den histologischen Grad III, während das bei den restlichen Tumoren nur bei 51 % der Fall war [9].
Nielsen et al. (2004) berichteten über eine immunhistochemische Charakterisierung von basalähnlichen Brusttumoren. Sie ermittelten
dass es sich bei Karzinomen, die ER-, PR- und ERBB2-negativ sowie positiv für Zytokeratin 5/6 und/oder ERBB1 (epidermaler
Wachstumsfaktor-Rezeptor) sind, mit Sicherheit um basalähnliche Tumoren handelt. Die Sensitivität dieses Kriteriums belief
sich auf 76 % [10].
Brustkrebs, der sich bei Trägerinnen einer BRCA1-Genmutation – insbesondere den unter 50-Jährigen – entwickelt, ist weit
überwiegend dreifach negativ und gleicht im Genexpressionsmuster basalähnlichen Tumoren [12]. Ferner mehren sich die
Indizien dafür, dass bei spontanen dreifach negativen und basalähnlichen Mammatumoren zumindest ähnliche
Pathomechanismen wie bei BRCA1-Mutation-positiven Tumoren beteiligt sind. Auch in sporadisch auftretenden
basalähnlichen Tumoren ist der BRCA1 Pathway trotz des intakten BRCA1-Gens nicht funktionstüchtig [13, 14].
Petit et al. präsentierten auf dem ASCO 2007 Daten von retrospektiven Analysen der Wirksamkeit Anthrazyklin-basierter neoadjuvanter Therapien bei dreifach rezeptornegativem Brustkrebs gesondert nach BRCA1-Status. Ihre Ergebnisse legen nahe, dass mit einer BRCA1-Mutation verbundene dreifach negative Brusttumoren deutlich schlechter auf eine Anthrazyklin-Therapie ansprechen als solche ohne BRCA1-Mutation [17]. Das deckt sich mit Ergebnissen aus In-vitro-Untersuchungen, die ergeben haben, dass der Verlust der BRCA1-Funktion mit Resistenz gegenüber Anthrazyklinen und erhöhter Sensitivität gegenüber Platinverbindungen verbunden ist.
Gluz et al. (2008) zeigten, dass Patientinnen mit dreifach negativem Hochrisiko-Brustkrebs deutlich von der Therapie mit
einem Hochdosisregime (zwei Zyklen E90C600 alle zwei Wochen gefolgt von zwei Zyklen E90C3000Thiotepa400 alle drei Wochen)
profitieren können [18]
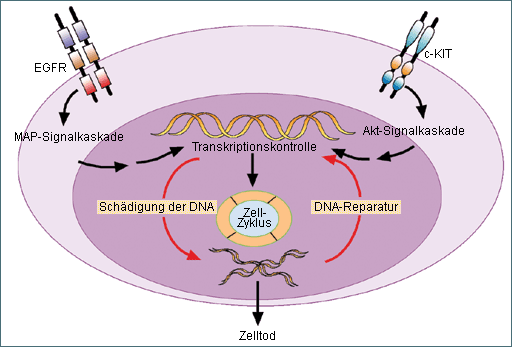
der mitogen activated Protein (MAP)-Kinase- und der Akt-Reaktionsweg (Abb. 2). Zwischen beiden Signalkaskaden bestehen Querverbindungen. Neben dem EGFR und c-Kit können verschiedene andere Komponenten der proliferativen Signalkaskaden überexprimiert oder mutiert sein und stellen potentielle Ziele zukünftiger Therapieansätze dar.
Etwa 60 % aller dreifach rezeptornegativen Tumoren exprimieren EGFR [10]. Als Wirksubstanzen, die gegen den Rezeptor gerichtet sind, kommen monoklonale Antikörper (Cetuximab) in Frage, die an die extrazelluläre Domäne des von EGFR binden und die Signaltransduktion inhibieren. Ferner können auch kleinmolekulare Inhibitoren (Gefitinib, Erlotinib) mit ATP um die Bindung an der intrazellulären Tyrosinkinase-Domäne konkurrieren und so die Phosphorylierung des Rezeptors hemmen. O´Shaughnessy et al. präsentierten auf dem San Antonio Cancer Symposium 2007 Ergebnisse einer Phase-II-Studie zu wöchentlich Irinotecan/Carboplatin mit oder ohne Cetuximab. Die Ansprechraten betrugen 49 % bzw. 30 %. Allerdings war die Therapie mit Cetuxinib mit erhöhter Toxozität verbunden [19]. Das Rezeptorprotein c-Kit-Tyrosinkinase wird in ca. 30 % der basalähnlichen Mammakarzinome exprimiert [10]. Inwieweit c-Kit-Tyrosinkinaseinhibitoren wie Imatinib oder Desatinib in solchen Fällen wachstumshemmend wirken ist indes noch nicht abschließend geklärt.
Bei BRCA1-Mutation- oder BRCA2-Mutation-assoziiertem dreifach negativen Brustkrebs gelten PARP-1 (Poly [ADP-Ribose]
Polymerase 1)-Inhibitoren als viel versprechende Agentien, um durch Akkumulation von DNA-Doppelstrangbrüchen, die
unter normalen Umständen repariert würden, das Apoptoseprogramm auszulösen.
Literatur: [1] Perou CM, Sorlie T, Eisen MB, et al. 2000. Molecular portrait of human breast tumours. Nature 406:747-752. [2] Sorlie T, Perou CM, Tibshirani R, et al. 2001. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implicatins. Proc Natl Acad Sci USA 98:10869-10874. [3] Weigelt B, Hu Z, He X, et al. 2005. Molecular portraits and 70-gene prognosis signature are preserved throughout the metastatic process of breast cancer. Cancer Res 65:9155-9158. [4] Wetzels RH, Holland R, van Haelst UJ, et al. 1989. Detection of basement membrane components and basal cell keratin 14 in noninvasive and invasive carcinomas of the breast. Am J Pathol 134:571-579. [5] Kreike B, van Kouwenhove M, Horlings H, et al. 2007. Gene expression profiling and histopathological characterization of triple-negative/basal-like breast carcinomas. Breast Cancer Res 9:R65 doi:10.1186/bcr1771 [6] Kang SP, Martel M, Harris LN, 2008. Triple negative breast cancer: current understanding of biology and treatment options. Curr Opin Obstet Gynecol 20:40-46. [7] Irvin WJ Jr, Carey LA, 2008. What is triple-negative breast cancer. doi:10.1016/j.ejca2008.09.034 [8] Reis-Filho JS, Tutt ANJ, 2008. Triple negative tumours: a critical review. Histopathology 52:108-118. [9] Bertucci F, Finetti P, Cervera N, et al. 2008. How basal are triple-negative breast cancers? Int J Cancer 123:236-240. [10] Nielsen TO, Hsu FD, Jensen K, et al. 2004. Immunohistochemical and clinical characterization of basal-like subtype of invasive breast carcinoma. Clin Cancer Res 10:367-474. [11] Bennett CB, Westmoreland TJ, Verrier CS, et al. 2008. Yeast screens identify the RNA polymerase II CTD and SPT5 as relevant targets of BRCA1 interaction. PLoS ONE 3:e1449. [12] Sorlie T, Tibshirani R, Parker J, et al. 2003. Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci USA 100:8418-8423. [13] Turner NC, Reis-Filho JS, Russell AM, et al. 2007. BRCA1 dysfunction in sporadic basal-like breast cancer. Oncogene 14:2126-2132. [14] Turner NC, Reis-Filho JS, 2006. Basal-like breast cancer and the BRCA1 phenotype. Oncogene 25:5846-5853. [15] Cleator S, Heller W, Coombes RC, 2007. Triple-negative breast cancer: therapeutic options. Lancet Oncol 8:235-244. [16] Carey LA, Dees EC, Sawyer L, et al. 2007. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes. Clin Cancer Res 13:2329-2334. [17] Petit R, Wilt M, Rodier J, et al. 2007. Are BRCA1 mutations a predictive factor for anthracycline-based neoadjuvant chemotherapy response in triple-negative breast cancers? J Clin Oncol 25(suppl):580. [18] Gluz O, Nitz UA, Harbeck N, et al. on behalf of the West German Study Group. 2008. Triple-negative high-risk breast cancer derives particular benefit from dose intensification of adjuvant chemotherapy: results of WSG AM-01 trial Ann Oncol 19:861-870. [19] O’Shaughnessy J, Weckstein D, Vukelja S, et al. 2007. Preliminary results of a randomized phase II study of weekly irinotecan/carboplatin with or without cetuximab in patients with metastatic breast cancer. (#308). Breast Cancer Res Treat 106(suppl 1):32. | ||||||
| ||||||