|
| ||||||||||||||||||||
|
Wie „systemisch“ ist Brustkrebs?
Inwieweit Früherkennung zur Senkung der Brustkrebsmortalität beitragen kann, hängt im Wesentlichen
Nach heutigem Verständnis der Biologie des Brustkrebses ist die Krankheit absolut sicher heilbar, sofern zwei Voraussetzungen erfüllt sind: Zum einen muss die Behandlung erfolgen, bevor sich Zellen vom Tumor gelöst und entfernt haben. Zum anderen dürfen bei der Resektion keine Tumorzellen im Operationsfeld verbleiben. Dass diese Idealbedingungen vielfach nicht erfüllt sind, verdeutlicht die hohe Rezidivrate, insbesondere wenn keine zusätzliche lokale Strahlentherapie erfolgt.
In Übereinstimmung mit der Vorstellung, Brustkrebs sei in einem frühen Stadium vielfach noch nicht
systemisch, sollte von der Früherkennung eine Verbesserung der Überlebensrate zu erwarten sein.
Diesbezüglich steht das Mammographie-
Offiziell hat sich in zahlreichen Ländern wie auch in Deutschland die Überzeugung durchgesetzt, Brustkrebsfrüherkennung
mittels Mammographie erhöhe die Heilungschancen für die betroffenen Frauen. Beruhend auf einem Bundestagsbeschluss vom
Juni 2002 wird auf der Grundlage der „Europäischen Leitlinien für Qualitätssicherung des Mammographie-
Rückendeckung erhält diese Entscheidung durch die mehrheitlich positiven Ergebnisse einschlägiger Untersuchungen.
Insbesondere jüngst zu diesem Thema publizierte Arbeiten aus verschiedenen Ländern bestätigen den Nutzen des breiten
Mammakarzinom-Screenings hinsichtlich verbesserter Mortalitätsraten [3-6].
Das Screening zur Entdeckung von Lokalrezidiven bei Mammakarzinompatientinnen nach brusterhaltender Operation,
die normalerweise eine Strahlentherapie erhalten haben, unterscheidet sich im Grundsatz nicht vom Screening nach einem
neuen Primärkrebs in der kontralateralen Brust [7]. Zu beachten ist indes, dass nach brusterhaltender Therapie häufig
unvorhersehbare mammographische Veränderungen auftreten. Das führt leider zu einer zum Teil als inakzeptabel hoch
empfundenen Rate an negativen Biopsien. Deshalb fahndeten Wapiwala et al. (2007) nach Merkmalen, die als Prädiktoren
für einen positiven Biopsiebefund dienen können. Als solche wurden sowohl mammographische als auch klinische Anomalien,
ein jüngeres Alter bei der Brustkrebsdiagnose, Exzisions- oder Stanzbiopsien und ein größerer zeitlicher Abstand zum
Abschluss der Strahlentherapie ermittelt [8].
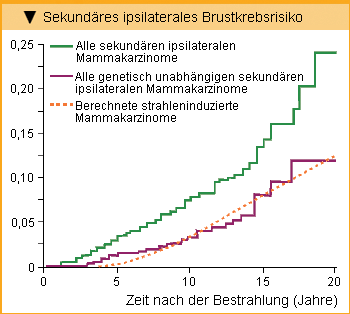
Die Brustkrebsrate sekundärer, vom primären Karzinom genetisch unabhängiger Tumoren ist erheblich höher als die allgemein in der weiblichen Bevölkerung beobachtete Brustkrebsrate. Somit stellt sich die Frage, inwieweit sich die nach konservativer Brustkrebsbehandlung obligate Strahlenbehandlung auf das Risiko für die Entwicklung von sekundärem Brustkrebs auswirkt. Infolge einer Bestrahlung der Brust mit 50 Gy sind Frauen langfristig einem erhöhten strahlungsbedingten Brustkrebsrisiko ausgesetzt. Berechnungen dieses Risikos in der ipsilateralen Brust nach brusterhaltender Operation von Brenner et al. (2007) ergaben, dass praktisch das gesamte Risiko für einen genetisch unabhängigen sekundären Brustkrebs allein auf die Strahlenexposition zurückzuführen ist (Abb. 1). Das bedeutet aber auch, dass das „normale“ Risiko für einen genetisch unabhängigen Brustkrebs in der ipsilateralen Brust durch die Bestrahlung eliminiert wird. Insgesamt ergibt sich durch die Bestrahlung in der ipsilateralen Brust kein zusätzliches Risiko für sekundären Brustkrebs [10].
Sekundäre, vom Primärtumor genetisch unabhängige Mammakarzinome treten bei Patientinnen mit einem frühen Brustkrebs nach Strahlentherapie auch gehäuft in der kontralateralen Brust auf. Berechnungen von Brenner et al. (2007) haben ergeben, dass die durchschnittliche Strahlendosis, die die gegenüberliegende Brust bei einer Bestrahlung der Brust mitbekommt, weniger als 10% beträgt und nicht ausreicht, das strahlungsbedingte Risiko signifikant zu erhöhen. Warum soll sich daher in der kontralateralen Brust von Brustkrebspatientinnen häufiger Karzinome bilden als es der Rate in der weiblichen Bevölkerung entspricht, während das entsprechende Risiko in der ipsilateralen Brust sogar praktisch nivelliert wird? Die Autoren glauben dieses scheinbare Paradoxon auf die bei Brustkrebspatientinnen von vornherein stärker ausgeprägte Suszeptibilität für Brustkrebs zurückführen zu können. In der bestrahlten ipsilateralen Brust werden prämaligne Zellen, die vor der Bestrahlung vorhanden waren, hingegen abgetötet, so dass das inhärente Brustkrebsrisiko der Patientin in dieser Brust eliminiert ist [10].
In einem aktuellen Übersichtsartikel zur lokalen Therapie und Überleben bei Brustkrebs resümieren Punglia et al. (2007), dass aus
den Ergebnissen zahlreicher Studien zum Mammographie-
Neben der lokalen Therapie tritt bei frühem Brustkrebs die adjuvante systemische Therapie zunehmend in den Vordergrund. Auch durch solche
Therapien – ob endokrin oder zytotoxisch – verringert sich das Risiko eines Lokalrezidivs signifikant [13]. Dieser Effekt ist
deutlich stärker ausgeprägt, wenn die systemische Therapie in Kombination mit einer postoperativen Strahlentherapie erfolgt. Beispielsweise
betrug die Rate ipsilateraler Lokalrezidive bei Patientinnen mit einem nodal negativen, zumeist Hormonrezeptor-positiven Brustkrebs allein
mit Tamoxifen nach fünf Jahren 7,7%. Wurde zudem auch eine Strahlentherapie durchgeführt verringerte sich die Rate auf 0,6% [14].
Demzufolge sind echte Rezidive eines behandelten Mammakarzinoms unter Umständen anders zu behandeln als genetisch unabhängig entstandene
ipsilaterale Tumoren und bedürfen zumeist einer aggressiven systemischen Therapie. Doch wie soll zwischen echtem Rezidiv und Primärtumor
unterschieden werden? Klinische Klassifikationen erwiesen sich hierbei als wenig aussagekräftig. Deutlich verlässlicher ist ein molekulares
Klonalitäts-
Der axilläre Lymphknotenstatus gilt allgemein als bedeutsamster prognostischer Faktor für Brustkrebspatientinnen. Um ihn verlässlich zu
ermitteln, reicht es nach heutiger Erkenntnis aus, nur wenige so genannte Sentinel-
Zur Untersuchung der Lymphknoten auf Metastasen fertigt der Pathologe dünne Gewebeschnitte an, die nach Anfärben mit Hämatoxylin und Eosin
(HE) im Lichtmikroskop durchmustert werden. Allerdings lässt sich mit dieser Technik eine bereits im metastasierten Stadium befindliche
Krankheit nicht in jedem Fall erkennen. Schon vor Einführung der Sentinel-
Erheblich besser als bei der routinemäßigen HE-Methode lassen sich kleine und kleinste metastatische Ablagerungen im Lymphknotenparenchym
oder auch im Knochenmark erkennen, wenn Serienschnitte mikroskopiert werden und/oder eine immunhistochemische Markierung erfolgt. Für eine
solche Markierung werden in erster Linie mit einem farbigen Marker komplexierte Antikörper verwendet, die gegen das Zytokeratin in den
Tumorzellen gerichtet sind. Insbesondere bei der Kombination von Serienschnitten mit immunhistochemischer Markierung lassen sich selbst
kleinste Zellhaufen und sogar isolierte Tumorzellen identifizieren.
Bezogen auf die Größe von Metastasen wurde vom American Joint Committee on Cancer (AJCC) ein revidiertes Staging-System eingeführt. Nach
dieser Definition werden Makrometastasen (>2,0 mm), Mikrometastasen (>0,2 bis 2,0 mm) und isolierte Tumorzellen (0,2 mm) unterschieden.
Hiernach wurden gemäß AJCC pN1mi beim Nachweis von Mikrometastasen und pN0(i+) beim Nachweis isolierter Tumorzellen in Lymphknoten als
pathologische Kategorien neu eingeführt. Dementsprechend ist pN0(i-) der Lymphknotenstatus frei von jeglicher metastatischer Läsion,
wodurch anders als bei der Bezeichnung pN0 deutlich gemacht wird, dass nach Mikrometastasen und isolierten Tumorzellen gefahndet wurde.
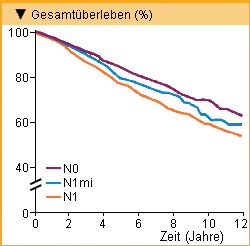
Nach dem aktuellen Staging-System der AJCC werden Mikrometastasen (N1mi) als nodal positiv und isolierte Tumorzellen [pN0(i+)] als nodal
negative Krankheit eingestuft.
In einer deutschen Arbeit von Ercegovic et al. (2007) hatten von 704 retrospektiv analysierten Patientinnen 64 (9,1%) ausschließlich
Mikrometastasen. Bei 48 dieser Frauen wurde eine axilläre Lymphonodektomie durchgeführt, wobei in 12 Fällen positive Nicht-Sentinel-
Mehrere Jahre zurückliegende Studien zur prognostischen Bedeutung von Mikrometastasen und/oder isolierten Tumorzellen in Lymphknoten beziehen sich überwiegend auf Patientinnen, bei denen Gewebeproben nach vollständiger axillärer Lymphknotendissektion untersucht worden sind. Hervorzuheben von diesen Studien ist eine grundlegende Untersuchung von Cote et al. (1999): Bei 736 ursprünglich als nodal negativ befundeten Brustkrebspatientinnen wurden nach eingehender pathologischer Reanalyse anhand von HE-gefärbten Serienschnitten 52 Fälle (7%) und bei zusätzlicher immunhistochemischer Keratinmarkierung sogar 148 Fälle nachträglich als positiv für okkulte Mikrometastasen erkannt. Der Nachweis okkulter Mikrometastasen war bei dieser Überprüfung mit einem signifikant kürzeren krankheitsfreien Überleben und kürzeren Gesamt-überleben verbunden. Hierbei spielte es keine Rolle, mit welcher Methode die okkulten Mikrometastasen letztendlich entdeckt worden waren. Der Überlebensnachteil beim Nachweis okkulter Mikrometastasen betraf interessanterweise nicht die prämenopausalen Patientinnen [19]. Dass auch isolierte Tumorzellen, die in Achsellymphknoten vorgefunden werden, Auswirkungen auf den Krankheitsverlauf und das Krankheitsergebnis haben können, berichteten Querzoli et al. (2006). Bei einer Neubegutachtung des histopathologischen Materials von 377 Brustkrebspatientinnen, die nach vollständiger axillärer Lymphknotendissektion als pN0 eingestuft worden waren, ließen sich in 13% der Fälle Zytokeratin-positive Einlagerungen <0,2 mm nachweisen. Solche pN0(i+)-Tumoren hatten eine signifikant höhere Wahrscheinlichkeit metastasiert zu rezidivieren als
Eine italienische Studie von Colleoni et al. (2005) stützt sich auf Daten von 1.959 Brustkrebspatientinnen, bei denen entweder nur eine
Sentinel-
Kahn et al. (2006) registrierten bei der Analyse eines Kollektivs von 224 Brustkrebs
Cox et al. (2008) fanden bei einer Nachbegutachtung der Objektträger von 2 381 Brustkrebspatientinnen in 151 Fällen Mikrometastasen (pN1mi)
und in 122 Fällen isolierte Tumorzellen pN0(i+) in den Sentinel-
In einer Studie mit 174 Brustkrebs-wbr>Patientinnen, bei der Sentinel-
Mit dem umfassendsten Datenmaterial zur Bestimmung des prognostischen Einflusses von pN1mi gegenüber pN0 oder pN1 (Makrometastasen in 3
Lymphknoten) warteten Chen et al. (2007) auf. Bei den insgesamt 209 720 Patientinnen und Patienten (0,6%) waren in den Jahren von 1992 bis
2003 entweder eine axilläre Lymphknotendissektion oder ab 1994 vorwiegend eine Sentinel-
Für die Prognose bei Brustkrebs ist nicht nur der Nodalstatus sondern auch der Nachweis von Mikrometastasen im Knochenmark von Bedeutung.
In einer von Braun et al. (2005) durchgeführten Metaanalyse von neun Studien mit insgesamt 4.703 Brustkrebspatientinnen wurden Mikrometastasen
im Knochenmark signifikant häufiger registriert, wenn auch Metastasen in den Lymphknoten vorgefunden wurden, und der Primärtumor größer, von
höherem histologischen Grad und Hormonrezeptor-
Ob und mit welchen endokrinen Therapien Mikrometastasen im Knochenmark Erfolg versprechend bekämpft werden können, wird gegenwärtig in
einer Studie der Austrian Breast & Colorectal Cancer Study Group, an der sich 28 Zentren in drei europäischen Ländern beteiligen, untersucht.
[1] Gotzsche PC, Olsen O, 2000. Is screening for breast cancer with mammography justifiable? Lancet 355:129-134. [2] Olsen O, Gotzsche PC, 2001. Cochrane review on screening for breast cancer with mammography. Lancet 358:1340-1342. [3] Parvinen I, Helenius H, Pylkkänen L, et al. 2006. Service screening mammography reduces breast cancer mortality among elderly women in Turku. J Med Screen 13:34-40. [4] Goldman A, Phillips N, Warren L, Kan L. 2007. Breast cancer mortality after screening mammography in British Columbia women. Int J Cancer 120:1976-1080. [5] Gabe R, Tryggyadóttir L, Sigfússon BF, et al. 2007. A case control study to estimate the impact of the Icelandic population-based mammography screening program on breast cancer death. Acta Radiol 48:948-955. [6] Allgood PC, Warwick J, Warren RM, et al. 2008. A case-control study of the impact of the East Anglian breast screening programme on breast cancer mortality. Br J Cancer 98:206-209. [7] Hayes DF, 2007. Follow-up of patients with early breast cancer. N Engl J Med 356:2505-2513. [8] Vapiwala N, Starzyk J, Harris EE, et al. 2007. Biopsy findings after breast conservation therapy for early-stage invasive breast cancer. Int J Radiat Oncol Biol Phys 69:490-497. [9] Freedman GM, Anderson PR, Hanlon AL, et al. 2005. Pattern of local recurrence after conservative surgery and whole-breast irridation. Int J Radiat Oncol Biol Phys 61:1328-1336. [10] Brenner DJ, Shuryak I, Russo S, Sachs RK, 2007. Reducing second breast cancers: a potential role for prophylactic mammary irridation. J Clin Oncol 25:48684872. [11] Clarke M, Collins R, Darby S, et al. 2005. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 366:2087-2106. [12] Punglia RS, Morrow M, Winer EP, Harris JR, 2007. Local therapy and survival in breast cancer. N Engl J Med 356:2399-2405. [13] Early Breast Cancer Trialists´ Collaborative Group, 2005. Effects of chemotherapy and hormonal therapy for breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet 365:1687-1717. [14] Fyles AW, McCready DR, Manchul LA, et al. 2004. Tamoxifen with or without breast irridation in women 50 years of age or older with early breast cancer. N Engl J Med 351:963-970. [15] Goldstein NS, Vicini FA, Hunter S, et al. 2005. Molecular clonality determination of ipsilateral recurrence of invasive breast carcinomas ofter breast-conserving therapy: comparison with clinical and biologic factors. Am J Clin Pathol 123:679-689. [16] Goldstein NS, Vicini FA, Hunter S, et al. 2005. Molecular clonality relationships in initial carcinomas, ipsilateral breast failures, and distant metastases in patients treated with breast-conserving therapy: evidence suggesting that some distant metastases are derived from ipsilateral breast failures and that metastases can metastasize. Am J Clin Pathol 124:49-57. [17] Vicini FA, Vito AJ, Goldstein N, et al. 2007. The use of molecular assays to establish definitively the clonality of ipsilateral breast tumor recurrences and patterns of in-breast failure in patients with early-stage breast cancer treated with breast-conserving therapy. Cancer 109:1264-1272. [18] Ercegovic S, Kußmaul J, Stremovskaia T, et al. 2007. Prognostische und therapeutische Relevanz von Mikrometastasen in Sentinel Lymphknoten (SLN) bei Mamma-Carcinomen. Senologie – Zeitschrift für Mammadiagnostik und -therapie. 4, DOI:10.1055/s-2007-982924. [19] Cote RJ, Peterson HF, Chaiwun B, et al. 1999. Role of immunhistochemical detection of lymph-node metastases in management of breast cancer. International Breast Cancer Study Group. Lancet 354:896-900. [20] Querzoli P, Pedriali M, Rinaldi R, et al. 2006. Axillary lymph node nanometastases are prognostic factors for disease-free survival and matastatic relapse in breast cancer patients. Clin Cancer Res 12:6696-6701. [21] Colleoni M, Rotmensz N, Peruzzotti G, et al. 2005. Size of breast cancer metastases in axillary lymph nodes: clinical relevance of minimal lymph node involvement. J Clin Oncol 23:13791389. [22] Kahn HJ, Hanna WM, Chapman JA, et al. 2006. Biological significance of occult micrometastases in histologically negative axillary lymph nodes in breast cancer patients using the recent American Joint Committee on Cancer breast cancer staging system. Breast J 12:294-301. [23] Cox CE, Kiluk JV, Riker AI, et al. 2008. Significance of sentinel lymph node micrometastases in human breast cancer. J Am Coll Surg 206:261-268. [24] Rydén L, Chebil G, Sjörström L, et al. 2007. Determination of sentinel lymph node (SLN) status in primary breast cancer by prospective use of immunhistochemistry increases the rate of micrometastases and isolated tumour cells: analysis of 174 patients after SLN biopsy. Eur J Surg Oncol 33:33-38. [25] Chen SL, Hoehne FM, Giuliano AE. 2007. The prognostic significance of micrometastases in breast cancer: a SEER population-based analysis. Ann Surg Oncol 14:3378-3384. [26] Mittendorf EA, Hunt KH. 2007. Significance and management of micrometastases in patients with breast cancer. Expert Rev Anticancer Ther 7:1451-1461. [27] Braun S, Vogl FD, Naume B, et al. 2005. A pooled analysis of bone micrometastasis in breast cancer. N Engl J Med 353:793-802.
|
| |||||||||||||||||||